- Produits
- Catalogues
- News & Trends
- Salons
Logiciel de gestion EU MDRde qualitéde conceptionde base de données ODBC
Ajouter à mes favoris
Ajouter au comparateur
Caractéristiques
- Fonction
- de gestion, de qualité, de conception, de base de données ODBC, de sécurité, de suivi, de supply chain, d'étiquetage
- Applications
- de process, médicale
- Type
- centralisé
- Autres caractéristiques
- sur mesure
Description
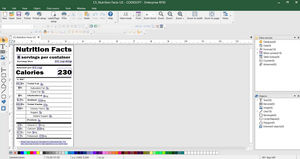
Créez et imprimez facilement des étiquettes conformes au EU MDR
CODESOFT pour la création d'étiquettes EU MDR
Industrie des produits de santé (HIBC) et création de codes à barres GS1 Databar
Assistants faciles à utiliser
Créez des droits d'utilisateur et activez les contrôles de sécurité des étiquettes
TEKLYNX CENTRAL CFR pour la gestion de l’étiquetage
Extrayez les éléments d'étiquette d'une base de données centralisée pour des étiquettes conformes à EU MDR
Automatiser le processus d'étiquetage avec une gestion centralisée pour assurer l'application du processus et un contrôle supplémentaire
Les organisations qui distribuent des dispositifs médicaux dans l'UE doivent se conformer au règlement EU MDR établi en mai 2017.
Le MDR (règlement relatif aux dispositifs médicaux) de l'UE vise à garantir la santé publique et la sécurité des patients dans toute l'Europe et à améliorer la qualité et la transparence des dispositifs médicaux dans la chaîne d'approvisionnement des soins de santé par le biais de standardisation de la conception, de l'approbation et du suivi des étiquettes.
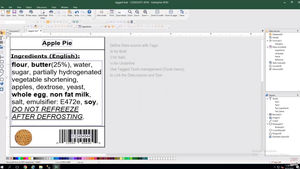
Ainsi, toutes les étiquettes de dispositifs médicaux, à l'exception des dispositifs fabriqués sur mesure et des dispositifs d'étude de performance/investigation, devront porter un identifiant unique de dispositif (UDI). Celui-ci comprend un identifiant de dispositif (DI), un identifiant de produit (PI) et des informations lisibles par l'homme (HRI). Les fabricants et distributeurs de dispositifs médicaux en Europe doivent se conformer aux normes d'étiquetage MDR de l'EU.
Catalogues
Aucun catalogue n’est disponible pour ce produit.
Voir tous les catalogues de TEKLYNXRecherches associées
- Solution logicielle d'automatisation
- Solution logicielle de gestion
- Solution logicielle d'analyse
- Solution logicielle de process
- Solution logicielle Windows
- Solution logicielle de commande
- Logiciel de CAO
- Solution logicielle temps réel
- Logiciel en ligne
- Solution logicielle de conception
- Logiciel d'interface
- Logiciel de qualité
- Logiciel automatisé
- Logiciel de développement
- Solution logicielle de réseau
- Logiciel de test
- Logiciel de création
- Solution logicielle de reporting
- Logiciel 2D
- Logiciel de sécurité
* Les prix s'entendent hors taxe, hors frais de livraison, hors droits de douane, et ne comprennent pas l'ensemble des coûts supplémentaires liés aux options d'installation ou de mise en service. Les prix sont donnés à titre indicatif et peuvent évoluer en fonction des pays, des cours des matières premières et des taux de change.